双重磅:揭秘维生素E促肺癌转移机制!科学家发现抗氧化剂促进癌症转移
奇点糕 奇点网 2018-07-09
抗氧化剂可实在是个大明星。
各种养生、保健以及护肤美容产品里,都能看到它的身影,并且还传出了具有抗癌的能力。
不过,事与愿违,今年初我们就报道过,抗氧化剂维生素E可不能乱吃,要是没有相应的基因突变,癌症风险不降反升。
最近一个瑞典团队的发现,再次给用于膳食补充的抗氧化剂:维生素E和N-乙酰半胱氨酸(NAC)一记重击。他们证实,这些抗氧化剂能够促进肺癌转移,相关研究发表在顶级学术期刊《细胞》上[1]。论文的通讯作者是Martin O. Bergo,第一作者是Clotilde Wiel。
而另一个美国团队也独立做出了类似的结果,论文同样发表在《细胞》上,通讯作者是Michele Pagano,第一作者是Luca Lignitto[2]。
这两项研究相互支撑,相互印证,向膳食补充的抗氧化剂开出了猛烈的炮火!

左:Michele Pagano(霍华德·休斯医学研究所)
右:Martin O. Bergo博士(卡洛琳斯卡医学院)
抗氧化剂这些年之所以这么火,在于人们对人体内活性氧的恐惧。
这些活性氧确实很可恶,它们具有很强的氧化能力,能够破坏细胞内的脂肪酸、蛋白质、DNA等物质。当然,一般情况下我们也不必过于担心,因为细胞能利用过氧化物酶、还原性物质(如维生素E)等,清除这些活性氧。
但是当活性氧过多时,那情况就不太妙了,能引发细胞的衰老和死亡。
活性氧对细胞的杀伤力有多大?事实上我们生活中常用的杀毒剂,84消毒液、氯气、高锰酸钾,以及洗碗柜里的臭氧等,最终都是通过产生活性氧来杀死细菌的。
在人体中,活性氧的增多与很多疾病的发生有关,如动脉硬化、高血压、白内障等。
并且,过去几十年,人们还认为活性氧会促进癌症的发生和发展。
 活性氧的作用(vitotox.com)
活性氧的作用(vitotox.com)
所以,乍一看,补充抗氧化剂(还原性物质)抵消掉可恶的活性氧似乎也在情理之中。
可是,活性氧既然是一把能杀菌、杀自身细胞的利剑,那它同样也能杀癌细胞。实际上,活性氧是人体处决自身叛变分子——癌细胞的武器。
已有科学家发现,活性氧是能限制癌症的发展,而补充抗氧化剂则会帮癌症扫除这个障碍[3]。
并且,他们还在小鼠中证实,维生素E和NAC能促进原发肺癌的进展[3]。当然,前提是Kras2基因发生了突变。
图片来自drweil.com
对于癌症来说,其最可怕的一点就是转移了。
抗氧化剂会促进癌症进展,那是否也会影响癌症转移呢?目前还没有人研究过。
这是一个迫切需要阐明的问题。
Martin团队的研究人员,在Kras2 单突和Kras2 p53双突的肺腺癌小鼠模型中进行了测试。
他们给肺腺癌小鼠喂食了一周的抗氧化剂(维生素E或NAC),发现这些吃抗氧化剂的肿瘤小鼠,淋巴结转移的发生率是对照组小鼠的6-7倍!不仅如此,抗氧化剂还会促进肺腺癌的远端转移。
研究人员分别将抗氧化剂组和对照组小鼠的癌细胞分离出来,在体外扩大培养,发现吃过抗氧化剂小鼠的癌细胞具有更强的侵袭性和转移能力。
当将它们通过静脉注射进小鼠体内后,发现抗氧化剂组的癌细胞远端转移能力远强于对照组,在肝脏、肾脏、心脏和胸腔都形成了大量的转移灶,并且进入淋巴结。
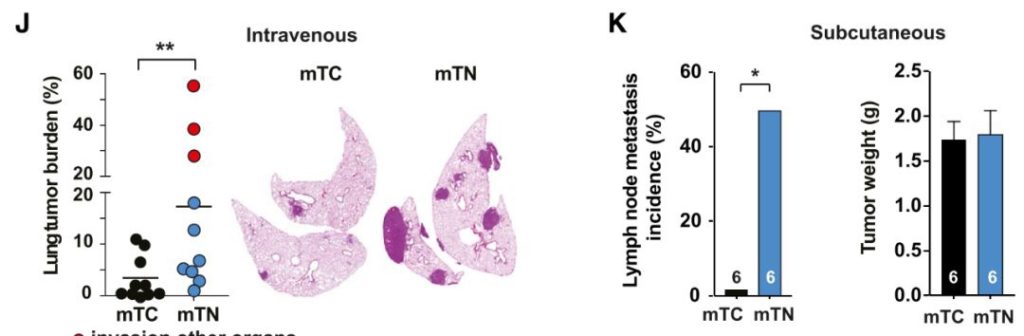 mTC是对照组,mTN是抗氧化剂组
mTC是对照组,mTN是抗氧化剂组
也就是说,抗氧化剂让癌细胞变得更加可怕了。
为什么吃了抗氧化剂的小鼠的癌细胞,会变得这么可怕呢?
研究人员赶快对它们进行了检测。
首先要检测的当然是活性氧水平。不出意外,这些癌细胞的活性氧水平要更低,这样看来,确实是抗氧化剂的“功劳”。
后面,他们经过一系列的实验揭示了抗氧化剂促进癌细胞转移的机制。
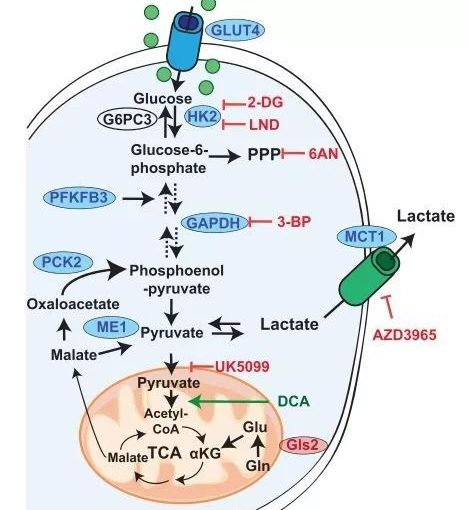
原来,抗氧化剂会清除细胞内的活性氧,并且降低细胞内游离血红素的水平,而这会使一个叫BACH1的蛋白的免于降解,增加其积累,而BACH1蛋白能够增强糖酵解途径[4,5]。
作者提到,BACH1蛋白增强糖酵解途径后,会增加乳酸的分泌,诱导周围健康细胞的凋亡,并促进细胞外基质的降解,创造癌细胞转移的有利条件;而糖酵解途径中的副产物,如丙酮醛等,会增强上皮-间质转化;此外,糖酵解产生的更多的ATP,还会为细胞骨架提供能量,增强癌细胞的运动能力。
抗氧化剂促进转移的分子机制
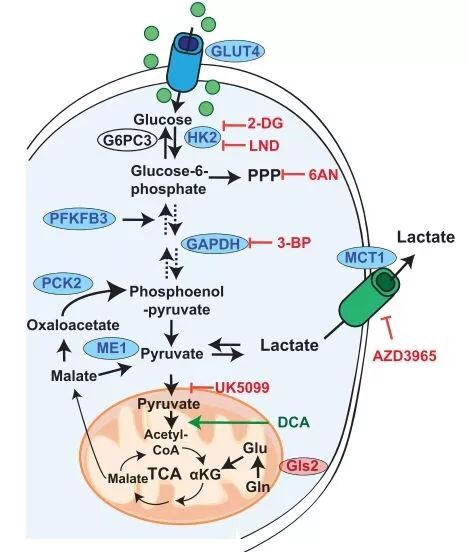 这些都会促进癌细胞的转移。
这些都会促进癌细胞的转移。
此外,BACH1蛋白早就被发现在肺腺癌患者中有高表达,并且与更差的预后有关。
这都说明,抗氧化剂可以通过增加BACH1蛋白的积累,促进癌症转移。
而同期发表在《细胞》上的另一项研究,也证实BACH1蛋白会促进肺腺癌细胞的转移。并且,他们还发现,在人类肺癌中出现频率达到30%的Keap1 或 Nfe2l2 突变,也会增强BACH1的水平,进而通过其下游的信号通路,促进肺癌转移。
因此, 这两个研究实际上在BACH1蛋白上交汇了,都揭示了肺癌转移的重要机制。
他们发现的机制,将为肺癌的治疗提供新靶点。
【免责声明】本文信息、图片均来源于网络,版权归原主所有。编者根据公开资料综合整理, 仅供各位参考